

样本处理剂指用于过敏、自免等抗体检测中,消除样本中异常干扰物质的前处理剂。主要组成成分为:含有磁微粒的冻干品。
样本处理剂的使用原理为:将样本和处理剂混合处理,磁微粒表面及其偶联的基团可以对样本中的非特异性物质进行吸附,并通过离心或磁分离除去,减少由非特异性结合造成的异常结果。
【非特异吸附的原因】
以携光生物自身抗体检测试剂盒为例:采用磁微粒化学发光免疫分析间接法,检测人血清/血浆样本中自身抗体IgG的浓度。反应过程为两步两清洗,待测样本与包被自免抗原的M磁微粒、R1缓冲液混匀并孵育 10min,经洗涤后加入 R2 碱性磷酸酶(AP)标记的鼠抗人IgG 二抗反应 10min,形成固相抗原-抗体-酶标二抗复合物,通过洗涤,未被结合的酶标抗体以及其它物质被去除。加入化学发光底物,发光底物在碱性磷酸酶的催化下发射出光子,所产生的光子数与样本中的自身抗体的浓度成正比。
而人血清中普遍存在异嗜性抗体,异嗜性抗体指人体内存在的多特异性抗体,此类抗体的产生与人体免疫应答有关。一般情况下,抗原暴露后人体免疫系统开始识别抗原并逐步产生亲和力不断提高的相关抗体。但在此过程中,同时也产生了低亲和力和非特异性的抗体。
异嗜性抗体可识别多种化学结构和自身抗原。试剂盒组份中的 M磁微粒表面存在各种化学基团(如经过修饰的甲苯磺酰基、羧基或链霉亲和素),或者对磁珠表面进行封闭时也会用到一些大分子蛋白,非特异性抗体可能会与这些基团或大分子蛋白结合,并在第二步反应时结合 R2 碱性磷酸酶(AP)标记的鼠抗人 IgG,从而干扰体外免疫检测产生非特异性信号,导致各种自身抗体检测结果为全阳。
大部分免疫学检测项目都会受到异嗜性抗体的干扰和影响,目前临床实践中发生上述异嗜性抗体干扰的概率为<0.05%(因不同检测项目和不同检测原理而略有不同)。
【使用场景】
当同一份样本在检测多个项目,出现多个项目同时阳性(包括临界阳性),尤其是与不同疾病相关的项目同时阳性时,高度提示异嗜性抗体干扰的存在。此时,建议使用样本处理剂对样本前处理后,再次上机复测。
此外,自身抗体作为自身免疫性疾病的血清学检测指标,检测结果应结合临床检查、病史和其它相关资料作出诊断。
【物料准备】
序号 | 品名 | 用量 | 使用说明 |
1 | 1000微升规格移液枪 | 1 | 移取样本 |
2 | 试管 | 2 | 装载样本 |
3 | 离心机 | 1 | 离心混匀样本 |
4 | 样本处理剂(冻干) | 1 | \ |
5 | 待处理样本 | 1 | \ |
【作业内容】
检验原理 | 将样本和处理剂混合处理,磁微粒表面及其偶联的基团可以对样本中的非特异性物质进行吸附,并通过离心或磁分离除去,减少由非特异性结合造成的异常结果。 | |
1.混匀反应 | A、准备好样本处理剂和待测样本,使用移液枪取500-1000ul样本加入一瓶处理剂中。(图1、2) | |
B、混匀瓶内的冻干物质,使其与待处理样本充分反应(图3,尽量避免气泡产生),在室温环境下静置15分钟。(图4) | ||
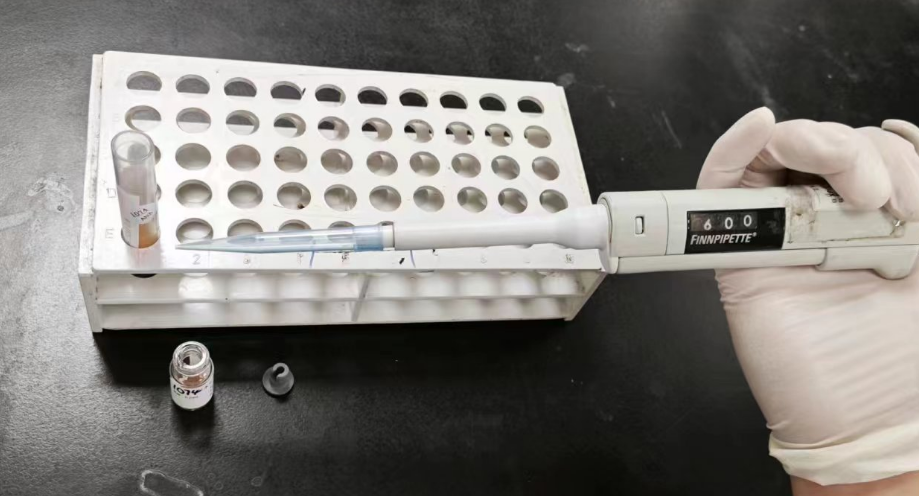
图1 |
图2 | |
图3 |
图4 | |
2.分离磁珠与样本 | A、使用移液枪将瓶中液体移取至试管中。(图5) | |
B、分离取出上清液: (1)方法1:使用磁分离装置,将混合物置于磁分离装置上,静置3-5分钟,待磁微粒被磁场吸附住,小心地吸出上清; (2)方法2:使用离心机,将混合物全部移取到离心管中,3000-7000RPM离心3-5分钟(图6),待磁微粒沉降于底部,小心地吸出上清(图7、8),并将上层清液中的气泡吸出以免影响实验。(图8) | ||
C、吸取上清时,如不小心携带出磁微粒,可重复第2步,样本处理后可用于后续检测。 | ||
D、对处理完成的样本重新进行上机测试前,需检查样本外观状态(不存在脂血、溶血)且样本上层无气泡(图9、10,气泡可能导致结果受影响)。 | ||
图5 |
图6 | |
图7 |
图8 | |
图9 |
图10 | |
【注意事项】
1、本品使用温度为15-25℃。
2、本品为冻干粉,使用时应该注意瓶口易污染。
3、本品不可重复使用,一瓶最大样本处理量1000uL,过多的样本可能影响处理效果。
4、本操作必须由医学检验专业人员或是经过培训的医生、护士或实验员使用。
5、妥善放置,避免非专业人员或儿童接触。
6、废液、废物、剩余产品以及受污染包装物的处理请遵守当地法规要求。
7、以下因素将干扰测试:
(1)试剂失效或过期;
(2)试剂被如尘埃等物质污染;
(3)与非本公司生产的试剂混合或联用。
参考文献
[1] Bertholf R L , Bowman M A . Microbeads, magnets, and magic: the enchanting science of immunochemistry.[J]. Annals of Clinical & Laboratory Science, 1996, 26(26):377-388.
[2] Wang Y F W , Kobayashi M . Antibody Detection: Principles and Applications[M]. Springer US, 2014.
[3] Levinson S, Miler J. Towards a beter understanding of hetrophile (and the like) antibody interfernce with modern imunoasays [J]. Clinca Chimca Acta 325 (202): 1-5.
[4] Boscato L M and Stuart M C. Heterophilic antibodies: a problem for all immunoassays.[J]. Clinical chemistry, 1988, 34(1) : 27-33.
[5] Rulander NJ, Cardamone D, Senior M, Snyder PJ, Master SR. Interference from antistreptavidin antibody.[J]. Arch Pathol Lab Med 2013;137:1141–6.
[6] Peltier L, Massart C, Moineau MP, Delhostal A, Roudaut N. Antistreptavidin interferences in Roche Thyroid immunoassays: a case report [letter]. Clin Chem Lab Med 2016;54:e11–4.
[7] Khieng V, Stevens C. Vitamin D toxicity? a case study. NZ J Med Lab Sci 2010;64:44–50.